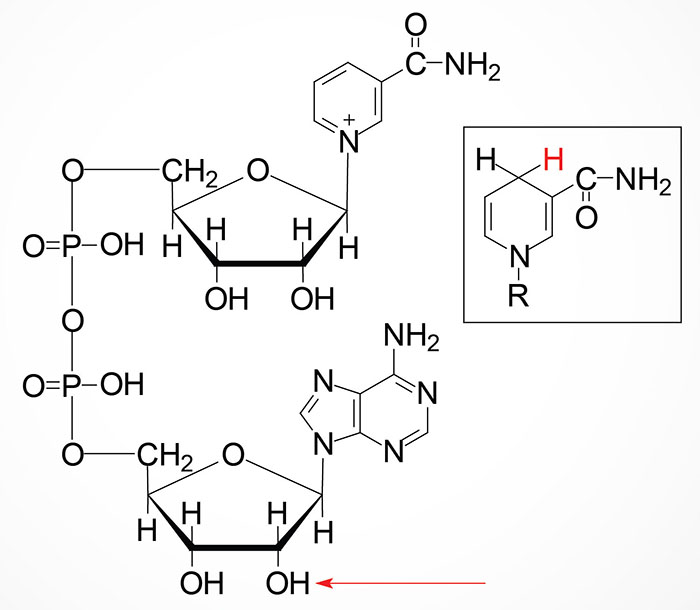
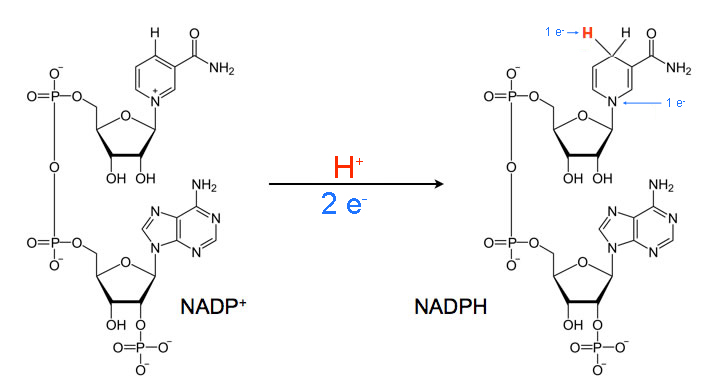
La NADPH-emoproteina reduttasi è un enzima appartenente alla classe delle ossidoreduttasi, che catalizza la seguente reazione:
- NADPH H n emoproteina ossidata ⇄ NADP n emoproteina ridotta
L'enzima è una flavoproteina (FMN, FAD) contenente sia FMN che FAD. Il numero n nell'equazione è 1 se l'emoproteina subisce una riduzione a 2-elettroni, ed è 2 se subisce una riduzione a 1-elettrone. L'enzima catalizza la riduzione delle monoossigenasi eme-tiolato-dipendenti, come la monoossigenasi aspecifica (numero EC 1.14.14.1), e la riduzione dell'eme ossigenasi (numero EC 1.14.99.3). Esso è parte del sistema microsomiale idrossilante. Riduce anche il citocromo b5 e il citocromo c.
Note
Bibliografia
- Williams, C.H., Jr. and Kamin, H., Microsomal triphosphopyridine nucleotide-cytochrome c reductase in liver, in J. Biol. Chem., vol. 237, 1962, pp. 587-595, Entrez PubMed 14007123.
- Masters, B.S.S., Bilimoria, M.H, Kamen, H. and Gibson, Q.H., The mechanism of 1- and 2-electron transfers catalyzed by reduced triphosphopyridine nucleotide-cytochrome c reductase, in J. Biol. Chem., vol. 240, 1965, pp. 4081-4088, Entrez PubMed 4378860.
- Masters, B.S.S., Kamin, H., Gibson, Q.H. and Williams, C.H., Jr., Studies on the mechanism of microsomal triphosphopyridine nucleotide-cytochrome c reductase, in J. Biol. Chem., vol. 240, 1965, pp. 921-931, Entrez PubMed 14275154.
- Lu, A.Y.H., Junk, K.W. and Coon, M.J., Resolution of the cytochrome P-450-containing ω-hydroxylation system of liver microsomes into three components, in J. Biol. Chem., vol. 244, 1969, pp. 3714-3721, Entrez PubMed 4389465.
- Gutierrez, A., Grunau, A., Paine, M., Munro, A.W., Wolf, C.R., Roberts, G.C.K. and Scrutton, N.S., Electron transfer in human cytochrome P450 reductase, in Biochem. Soc. Trans., vol. 31, 2003, pp. 497-501, Entrez PubMed 12773143.
- Horecker, B.L., Triphosphopyridine nucleotide-cytochrome c reductase in liver, in J. Biol. Chem., vol. 183, 1950, pp. 593-605.
- Munro, A.W., Noble, M.A., Robledo, L., Daff, S.N. and Chapman, S.K., Determination of the redox properties of human NADPH-cytochrome P450 reductase, in Biochemistry, vol. 40, 2001, pp. 1956-1963, Entrez PubMed 11329262.
- Haas, E., Horecker, B.L. and Hogness, T.R., The enzymatic reduction of cytochrome c, cytochrome c reductase, in J. Biol. Chem., vol. 136, 1940, pp. 747-774.
- Sevrioukova, I.F. and Peterson, J.A., NADPH-P-450 reductase: Structural and functional comparisons of the eukaryotic and prokaryotic isoforms, in Biochimie, vol. 77, 1995, pp. 562-572, Entrez PubMed 8589067.
- Wang, M., Roberts, D.L., Paschke, R., Shea, T.M., Masters, B.S.S. and Kim, J.-J.P., Three-dimensional structure of NADPH-cytochrome P450 reductase: Prototype for FMN- and FAD-containing enzymes, in Proc. Natl. Acad. Sci. USA, vol. 94, 1997, pp. 8411-8416, Entrez PubMed 9237990.
- Munro, A.W., Noble, M.A., Robledo, L., Daff, S.N. and Chapman, S.K., Determination of the redox properties of human NADPH-cytochrome P450 reductase, in Biochemistry, vol. 40, 2001, pp. 1956-1963, Entrez PubMed 11329262.
- Gutierrez, A., Grunau, A., Paine, M., Munro, A.W., Wolf, C.R., Roberts, G.C.K. and Scrutton, N.S., Electron transfer in human cytochrome P450 reductase, in Biochem. Soc. Trans., vol. 31, 2003, pp. 497-501, Entrez PubMed 12773143.